Nhân tiện đây viết một bài sơ sơ về pứ SN với E luôn cho doremon giải quyết phần nào thắc mắc nhé !
1.Đầu tiên là pứ SN, ai cũng biết pứ SN là cái quái gì rồi đúng không (bài này đang viết ở Bậc ĐH nên BM có thể yên tâm chuyện đó), chính vì vậy ta sẽ cùng nhau đi thẳng vào yếu tố theo BM có ảnh hưởng phức tạp là solvent:
+Ảnh hưởng khó chịu đối với một người phân tích cơ chế, đó là
dung môi:
Trong dung dịch xảy ra pứ, chất đầu, các sản phẩm cũng như các transition state đều bị solvate hoá. Khi một hệ bị solvate hoá năng lượng của hệ đó sẽ giảm. Nếu trong pứ độ phân cực của hệ tăng thì khi chuyển từ dung môi kém phân cực sang dung môi phân cực hơn, sự solvate hoá transition state sẽ càng mạnh hơn sự solvate hoá các chất đầu, do đó sự giảm năng lượng ở transition state sẽ càng lớn hơn ở trạng thái đầu và vận tốc pứ phải tăng. Như vậy, về mặt định tính, ta có thể nói độ phân cực là thước đo khả năng solvate hoá của dung môi: dung môi càng phân cực thì khả năng solvate hoá ion càng tăng. Ok?
Và điều trên cũng có nghĩa là dung môi càng phân cực thì pứ sẽ càng ưu thế cho thằng SN1.
Sự solvate hoá ở pứ SN1 là sự solvate hoá cả hệ thống, ta phải xét chi tiết sự làm bền anion bứt ra và carbocation tạo thành. Trong thực nghiệm, người ta đã chứng minh HCOOH có khả năng ổn định anion siêu việt hơn những thằng khác như phenol, rượu …, chính vì vậy, khi cấu tạo của chất nền ở nhị cấp (chọn nhị cấp để thấy rõ sự cạnh tranh), hay đôi khi ở chất nền nhất cấp, pứ vẫn ưu tiên chọn con đường SN1 mà đi, vì hệ thống lúc này được solvate hoá bền. Ở pứ SN2, sự solvate hoá transition state không có ý nghĩa lắm, vì lúc này điện tích bị phân tán trên nhiều tâm, chính vì vậy, cái ta quan tâm chính là ảnh hưởng solvate hoá của chất đầu và chất cuối, cụ thể hơn là anion đầu và anion cuối.
2.Đến pứ E, ta sẽ nói đến
cơ sở lí thuyết các qui tắc tách, và từ đó có sự so sánh một tí giữa
SN và E:
Ta phân biệt hai trường hợp, khi nhóm tách X là một nhóm trung hoà điện thì phản ứng sẽ bị tách ưu tiên qui tắc Zaixep, còn nếu nhóm tách X là một nhóm cồng kềnh, có mang điện tích thì lúc này phản ứng ưu tiên qui tắc Hopman.
a.Qui tắc Zaixep: Truớc hết, qui ước về cách gọi tên một chút, ta có mô hình X là nhóm bị tách ở vị trí
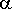
, còn proton bị tách ở vị trí
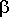

Nếu các nhóm thế R ở trên có khả năng làm bền trạng thái chuyển tiếp bằng các hiệu ứng liên hợp hay siêu liên hợp thì độ ổn định của trạng thái chuyển tiếp sẽ tăng. Mà theo qui luật chung thì phản ứng luôn luôn đi theo con đường có độ ổn định nhất (ít chông gai nhất). Đó là nội dung của qui tắc Zaixep.
Ex:

Yếu tố ảnh hưởng đến qui tắc Zaixep đó là basic được chọn, basic có kích thước lớn sẽ nảy ra vấn đề án ngữ không gian, nhất là án ngữ không gian giữa basic với các nhóm thế ở vị trí
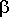
.
b.Qui tắc Hopman:
Các leave group lúc này có kích thước lớn, có mang điện tích, nên có thể coi một phần nào đó ở các chất đầu này là các intermediate, chính vì thế, việc cấu tạo sao cho intermediate bền thì phản ứng sẽ đi theo đúng cấu hình bền. Đó là nội dung của qui tắc Hopman.
Ex: Khi nhiệt phân (CH3)2CH-CH(+N(CH3)3)CH2CH3 ta có hai sơ đồ giả định sau:
Đầu tiên là mô hình mà H ở C bậc cao được tách:

Tiếp theo là mô hình mà H ở C bậc thấp được tách:

Ta thấy, ở mô hình thứ nhất, ngay ở chất đầu đã không bền, nên đương nhiên qui luật tất yếu sẽ không thể nào hướng phản ứng ưu tiên theo con đường thứ nhất (đó là con đường Zaixep). Ở mô hình thứ hai, nhóm tách tránh được bớt lập thể với một chú Me nên trở nên ưu tiên hơn, phản ứng xảy ra với hướng thứ hai.
Như vậy, rõ ràng phản ứng E2 của các hợp chất oni và các hợp chất khác có X cồng kềnh xảy ra theo qui tắc Hopman thuận lợi hơn qui tắc Zaixep. Hiệu suất của sp Hopman nói cfhung tăng theo kích thước của nhóm thế X.
Về cơ sở lý thuyết của qui tắc Hopman thì có rất nhiều, chẳng hạn như khi dùng hiệu ứng electron để giải thích cho giai đoạn chuyển tiếp, ta thấy do các group tách ra trong pứ E2 của các hợp chất oni có cấu tạo gần với một carbanion:

Chính vì thế, các nhóm thế hút e ở vị trí
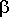
sẽ làm tăng độ ổn định, còn các nhóm alkyl đẩy e sẽ làm giảm độ ổn định.
Ngoài ra, người ta còn giải thích qui tắc Hopman bằng cách dựa vào tính acid của các H
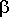
và
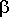
’. Đó là một cách so sánh rất quen thuộc nên BM ko cần phải nhắc lại nữa.
Nãy giờ nói cũng dài dòng chỉ để bây giờ giới thiệu cái chính, đó là mối liên hệ của SN và E reactions.



